
英语周报高一外研第27期答案
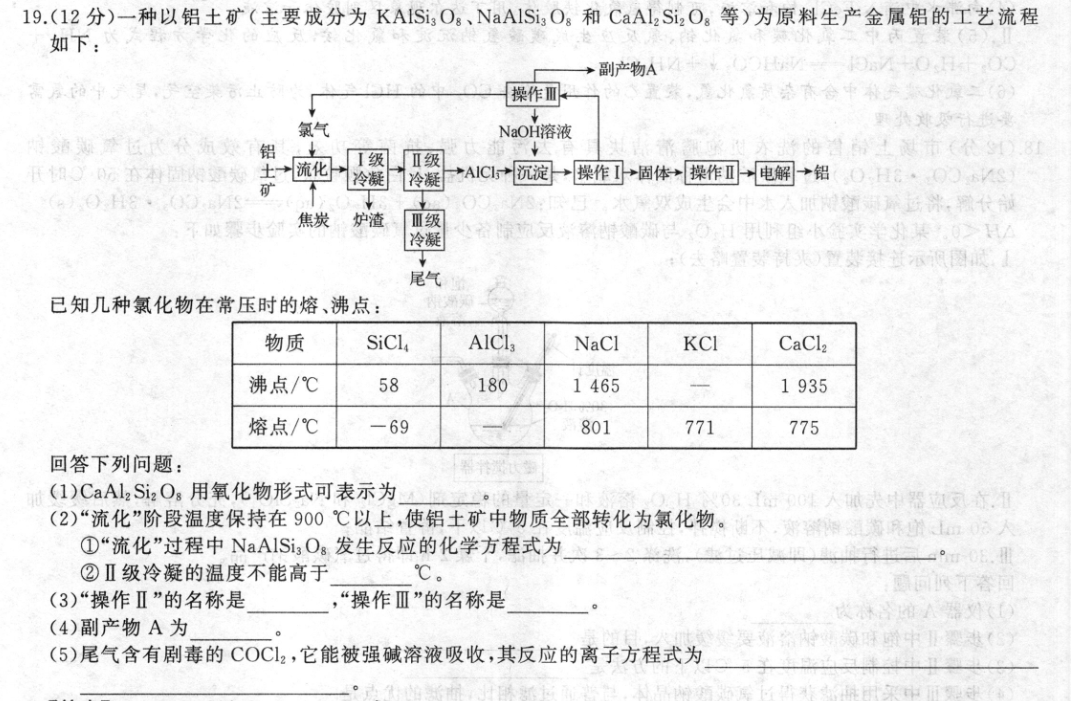


19.(12分)一种以铝土矿(主要成分为KAISi3Og、NaAlSi3O8和CaAl2Si2Og等)为原料生产金属铝的工艺流程如下:→副产物A⊙sA+00操作Ⅲ氯气NaOH溶液酒摩位代价须数铝任RO0示在村固阳经知→流化I级Ⅱ级冷凝冷凝*A1C1沉淀→操作I固体→操作口电解→铝OHC·OSAO18·083矿世阳领洗,激农领平理蔡州焦炭炉渣Ⅲ级冷凝发置礼火)型梦处武示风圆使尾气已知几种氯化物在常压时的熔、沸点:物质SiClAlClaNaClKCICaCl2沸点/℃5818014651935熔点/℃-69801771775回答下列问题:(1)CaAl2Si2Og用氧化物形式可表示为公了位00L人缺器边交亦.通(2)“流化”阶段温度保持在900℃以上,使铝土矿中物质全部转化为氯化物。谢下,的m0。①“流化”过程中NaAlSi3Og发生反应的化学方程式为4°过08②Ⅱ级冷凝的温度不能高于℃。圆可不答面(3)“操作Ⅱ”的名称是,“操作Ⅲ”的名称是(4)副产物A为要内娘为麻中患((5)尾气含有剧毒的COC12,它能被强碱溶液吸收,其反应的离子方程式为【答案】(1)CaO·Al2O3·2SiO2(2分)(2)①NaA1Si,O.+8C,+4C高温NaCl+A1Cl,+3SCL,+4CO,或NaA1Si,O。+8C,+8C高NaCl+AICl,十3SiCL,+8CO(2分)②180(2分)(3)煅烧(或灼烧)(1分)电解(1分)(4)H2(2分)(5)COCl2+4OH=C0?+2C1+2H2O(2分)【解析】铝土矿(主要成分为KAISi3Og、NaAlSis Os和CaAl2Si2Og等)和焦炭、氯气反应生成SiCL,、AlCl3NaCl、KCl、CaCl2、CO、CO2等,I级冷凝NaCl、KCl、CaCl2形成炉渣,而后经过Ⅱ级冷凝分离出AlCl3,SiCl,和COCl2经过Ⅲ级冷凝分离,AICl3加入适量的NaOH溶液形成Al(OH)3沉淀,过滤后的Al(OH)3经过煅烧生成氧化铝,电解熔融的氧化铝获得铝。(I)按金属性强弱从左到右写成氧化物的形式,且不能有分数,所以CaAl2Si2Og用氧化物形式可表示为CaO·Al2O3·2SiO2。(2)①“流化”过程中NaAlSi3Og与氯气和焦炭反应生成SiCl4、AlCl3、NaCl和碳的氧化物,所以发生反应的化学方程式为NaA1Si,0,+8C,十4C高温NaCl+A1C,+3SiCL,+4C0,或NaAISi,O,+8Cl,+8C高温NaCI十A1Cl3+3SiCl4+8CO。②Ⅱ级冷凝的目的是使A1CL3冷凝分离,所以温度不能高于180℃。(3)“操作Ⅱ”是Al(OH)3煅烧生成氧化铝,所以名称是煅烧,“操作Ⅲ”是电解NaCl溶液生成NaOH、Cl2和H2,所以名称是电解。(4)电解氯化钠溶液获得氯气、氢气和氢氧化钠,氯气和氢氧化钠循环利用,氢气为副产物,所以副产物A为H2。(5)COC2和强碱溶液反应可以生成对应价态的盐,所以离子方程式为COC2十4OHCO+2CI十2H2O。
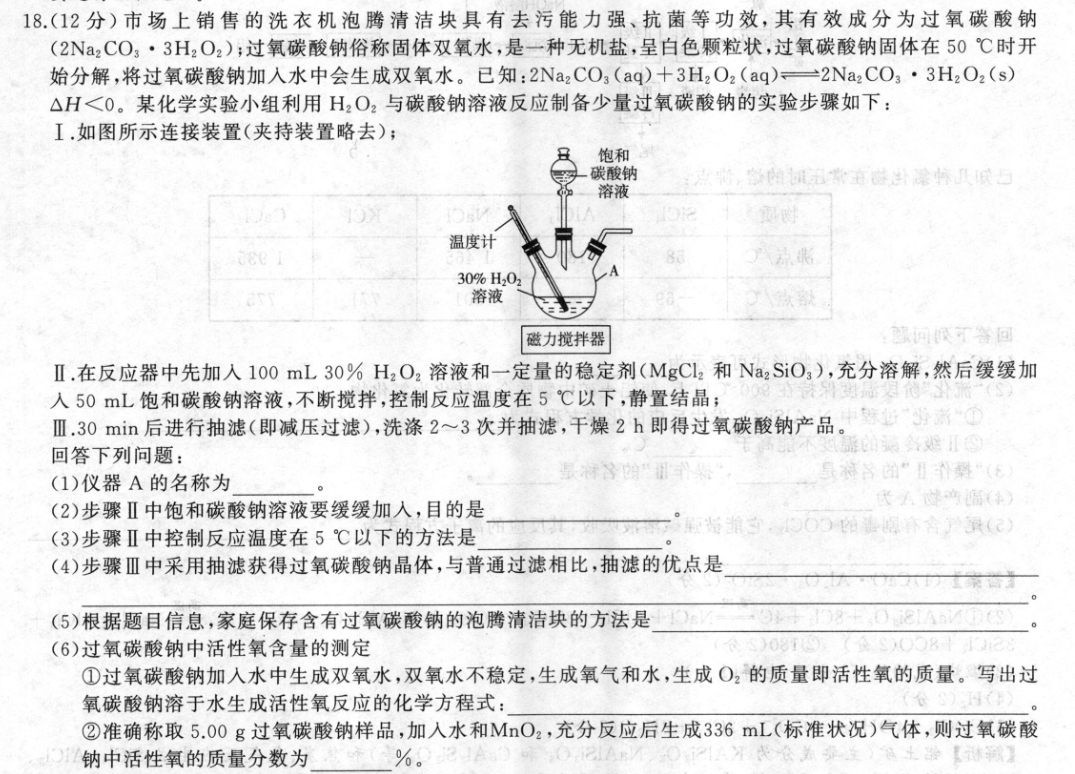


18.(12分)市场上销售的洗衣机泡腾清洁块具有去污能力强、抗菌等功效,其有效成分为过氧碳酸钠(2Na2CO3·3H2O2);过氧碳酸钠俗称固体双氧水,是一种无机盐,呈白色颗粒状,过氧碳酸钠固体在50℃时开始分解,将过氧碳酸钠加入水中会生成双氧水。已知:2Na2CO3(aq)十3H2O2(aq)一2Na2CO3·3H2O2(s)△H<0。某化学实验小组利用H2O2与碳酸钠溶液反应制备少量过氧碳酸钠的实验步骤如下:I.如图所示连接装置(夹持装置略去);饱和碳酸钠的五常味课中际贝厌■溶液温度计3030%H20:溶液磁力搅拌器碳回吸答回Ⅱ.在反应器中先加入100mL30%H2O2溶液和一定量的稳定剂(MgCl2和Na2SiO3),充分溶解,然后缓缓加入50mL饱和碳酸钠溶液,不断搅拌,控制反应温度在5℃以下,静置结晶;Ⅲ.30min后进行抽滤(即减压过滤),洗涤2~3次并抽滤,干燥2h即得过氧碳酸钠产品。回答下列问题:据组(1)仪器A的名称为县麻器的”日补驿“(无(2)步骤Ⅱ中饱和碳酸钠溶液要缓缓加入,目的是长幅((3)步骤Ⅱ中控制反应温度在5℃以下的方法是塔推的,⊙0O的海海舍算(配(4)步骤Ⅲ中采用抽滤获得过氧碳酸钠晶体,与普通过滤相比,抽滤的优点是(5)根据题目信息,家庭保存含有过氧碳酸钠的泡腾清洁块的方法是(6)过氧碳酸钠中活性氧含量的测定①过氧碳酸钠加人水中生成双氧水,双氧水不稳定,生成氧气和水,生成O2的质量即活性氧的质量。写出过氧碳酸钠溶于水生成活性氧反应的化学方程式:②准确称取5.00g过氧碳酸钠样品,加入水和MnO2,充分反应后生成336mL(标准状况)气体,则过氧碳酸钠中活性氧的质量分数为%。【答案】(1)三颈烧瓶(或三口烧瓶)(1分)(2)防止反应放热过快,使溶液温度过高,进而导致过氧化氢、过氧碳酸钠分解(2分):○○(3)将反应器置于冰水浴中(2分)(4)过滤速度快,液体和固体分离比较完全,滤出的固体易千燥(2分)外摩弘武从等会分((5)密封置于千燥、阴凉处(1分)(6)①2Na2C0,·3H,02—2Na2C03+3Hz02、2H2O2—2H20+O2↑{或2[2Na2C05·3H202]4Na2CO3+6H20十302↑}(2分)②9.6(2分)【解析】(1)仪器A的名称为三颈烧瓶(或三口烧瓶)。(2)2Na2C03(aq)+3H2O2(aq)一2Na2CO3·3HzO2(s)△H<0为放热反应,且过氧碳酸钠固体在50℃时开始分解,过氧化氢受热也易分解生成氧气和水,步骤Ⅱ中饱和碳酸钠溶液要缓缓加入,目的是防止反应放热过快,使溶液温度过高,进而导致过氧化氢、过氧碳酸钠分解。(3)步骤Ⅱ中控制反应温度在5℃以下的方法是将反应器置于冰水浴中。长有箱(4)与普通过滤相比,抽滤的优,点是过滤速度快,液体和固体分离比较完全,滤出的固体易千燥。(5)由于过氧碳酸钠具有强氧化性,在50℃时开始分解,遇水生成双氧水,双氧水不稳定,分解生成氧气和水,故家庭保存含有过氧碳酸钠的泡腾清洁块的方法是密封置于干燥、阴凉处,严禁与其他物品混放。(6)①过氧碳酸钠溶于水生成活性氧反应的化学方程式为2Na2CO3·3H2O2=2Na2CO3+3H2O2、2H2O2—2H2O+O2↑{或2[2Na2C03·3H202]=4Na2C03+6H20+302↑}.②5.00g过氧碳酸钠样品充分反应后生成336mL(标准状况)O2,其物质的量为0.336L÷22.4L·mol-10.015mol,质量为0.015mol×32g·mol-1=0.48g,生成02的质量即活性氧的质量,则过氧碳酸钠中活性氧的质量分0.48g×100%=9.6%。5.00g

以上就是英语周报高一外研第27期答案,更多英语周报答案请关注本网站。
本文地址: http://www.ncneedu.cn/post/26424.html
文章来源:admin
版权声明:除非特别标注,否则均为本站原创文章,转载时请以链接形式注明文章出处。
- 04-05 1 英语周报八年级新目标答案第29期
- 04-05 2 英语周报八年级新目标scc答案5
- 04-05 3 英语周报答案七年级上册2022-2023
- 04-05 4 英语周报答案2022~2023
- 04-05 5 英语周报答案八年级下册2023
- 04-05 6 英语周报答案九年级人教版2023
- 02-24 7 时代英语报2022-2023 test7答案
- 02-24 8 双语报答案20222023高三
- 02-24 9 双语报浙江W版中考专版第35期答案
- 02-24 10 双语报英语答案高三课标24期
- 英语周报八年级新目标答案第29期
2023-04-05admin
- 英语周报八年级新目标scc答案5
2023-04-05admin
- 英语周报答案七年级上册2022-2023
2023-04-05admin
- 英语周报答案2022~2023
2023-04-05admin
- 英语周报答案八年级下册2023
2023-04-05admin
- 英语周报答案九年级人教版2023
2023-04-05admin
- 时代英语报2022-2023 test7答案
2023-02-24admin
- 双语报答案20222023高三
2023-02-24admin
- 双语报浙江W版中考专版第35期答案
2023-02-24admin
- 双语报英语答案高三课标24期
2023-02-24admin
