
英语周报九年级上册期2023答案
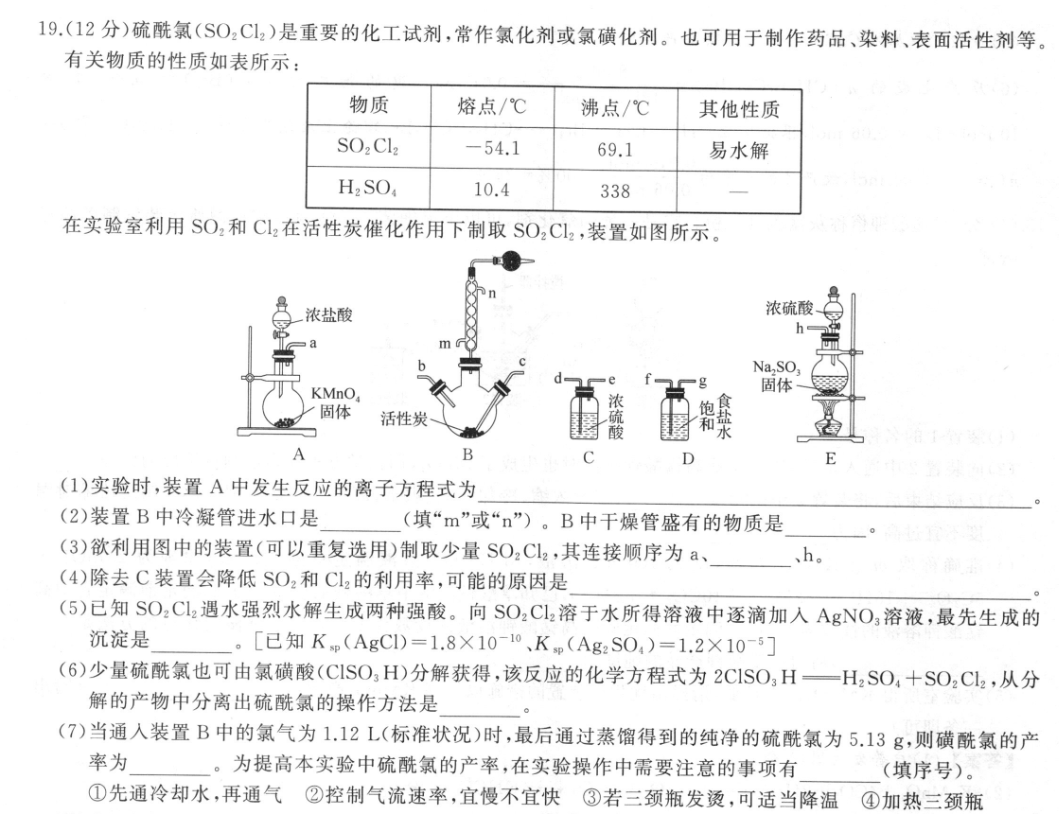


19.(12分)硫酰氯(SO2C2)是重要的化工试剂,常作氯化剂或氯磺化剂。也可用于制作药品、染料、表面活性剂等。有关物质的性质如表所示:物质熔点/℃沸点/℃其他性质SO2 Cl2-54.169.1易水解H2SO,10.4338在实验室利用SO2和C12在活性炭催化作用下制取SO2C12,装置如图所示。浓盐酸浓硫酸heNa,SO,KMnO固体固体活性炭食盐水B(1)实验时,装置A中发生反应的离子方程式为(2)装置B中冷凝管进水口是(填“m”或“n”)。B中干燥管盛有的物质是(3)欲利用图中的装置(可以重复选用)制取少量SO2Cl2,其连接顺序为a、、h。(4)除去C装置会降低SO2和C12的利用率,可能的原因是(5)已知SO2C12遇水强烈水解生成两种强酸。向SO2Cl2溶于水所得溶液中逐滴加入AgNO3溶液,最先生成的沉淀是。[已知Kp(AgCI)=1.8X10-10、Kp(Ag2S04)=1.2×10-5](6)少量硫酰氯也可由氯磺酸(CISO3H)分解获得,该反应的化学方程式为2C1SO3H一H2SO4+SO2C2,从分解的产物中分离出硫酰氯的操作方法是(7)当通入装置B中的氯气为1.12L(标准状况)时,最后通过蒸馏得到的纯净的硫酰氯为5.13g,则磺酰氯的产率为。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有(填序号)。①先通冷却水,再通气②控制气流速率,宜慢不宜快③若三颈瓶发烫,可适当降温④加热三颈瓶【答案】(1)10C1-+2MnO4+16H+-2Mn2++5Cl2个+8H2O(2分)》(2)m(1分)碱石灰(1分)(3)f、g、d、e、b、c、e、d(2分)(4)二氧化硫和氯气与水反应生成硫酸和氯化氢(1分)(5)AgC1(1分)(6)蒸馏(1分)(7)76.0%(2分)①②③(1分)【解析】本实验的目的是利用SO2和C2在活性炭催化作用下制取SO2Cl2,利用装置A可以制取氯气,氯气中混有挥发出来的HCI气体,经饱和食盐水可以除去HCI,然后用浓硫酸进行千燥,之后在装置B中和SO2进行反应;装置E可以制取SO2,经浓硫酸干燥后进入装置B中与氯气反应。(1)装置A中利用高锰酸钾氧化HCI制取氯气,根据得失电子守恒可知MO:和C-的化学计量数比为5:1,再结合元素守恒可得离子方程式为10C1+2MnO4十16H+一2Mn2++5Cl2个+8H2O。(2)为增强冷凝效果,冷却水下进上出,所以进水口为;B中千燥管内盛有的物质可以吸收剩余的二氧化硫、氯气,同时还可以防止空气中的水蒸气进入,所以为碱石灰。(3)装置A制备氯气,氯气中含氯化氢和水蒸气,通过装置D除去氯化氢,通过装置C吸收水蒸气,得到干燥纯净的氯气,连接装置B的b口进入三颈烧瓶,装置E制备二氧化硫气体,通过装置C除去水蒸气,连接装置B的c口,故其连接顺序为a、f、g、d、e、b、c、e、d、h。(4)若不经千燥,在有水的环境中二氧化硫与氯气和水发生反应SO2+C12十2H2O一H2SO4十2HCl,生成硫酸和氯化氢,降低SO2和Cl2的利用率。(5)S02Cl2遇水强烈水解生成的两种强酸应是H2SO,和HC,化学方程式为SO2Cl2+2H2OH2SO4十2HCl,根据题目所给数据可知Kp(AgCI)远小于Kp(Ag2SO,),且根据方程式可知产生的CI更多,需要银离子少,故AgCI先沉淀。(6)分离沸,点差别大的液体,用蒸馏的方法。(7)标准状况下,1.12LCl2的物质的量为0.05mol,故理论上可得到0.05molS02Cl2,即为0.05×135g=6.75g,所以S0,Cl,的产率为.138×100%=76.0%。为提高本实验中硫酰氯的产率,应减少S0,C,受热挥.75g发的量,使SO2、C2充分反应,可采取先通冷却水再通气,控制气流速率宜慢不宜快,若三颈瓶发烫应适当降温等措施,故答案为①②③。
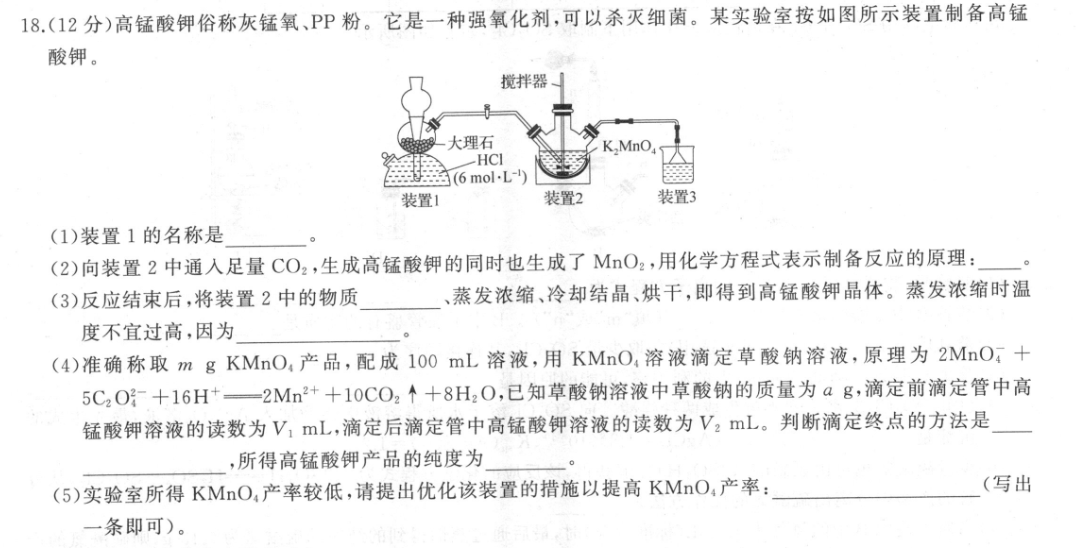

18.(12分)高锰酸钾俗称灰锰氧、PP粉。它是一种强氧化剂,可以杀灭细菌。某实验室按如图所示装置制备高锰酸钾。搅拌器大理石K.MnOHCI(6molL装置1装置2装置3(1)装置1的名称是(2)向装置2中通入足量CO2,生成高锰酸钾的同时也生成了MO2,用化学方程式表示制备反应的原理:(3)反应结束后,将装置2中的物质、蒸发浓缩、冷却结晶、烘干,即得到高锰酸钾晶体。蒸发浓缩时温度不宜过高,因为(4)准确称取m g KMnO,产品,配成100mL溶液,用KMnO,溶液滴定草酸钠溶液,原理为2MnO4+5C2O?+16H+一2Mn2++10CO2个+8H2O,已知草酸钠溶液中草酸钠的质量为ag,滴定前滴定管中高锰酸钾溶液的读数为V1mL,滴定后滴定管中高锰酸钾溶液的读数为V2mL。判断滴定终点的方法是,所得高锰酸钾产品的纯度为(5)实验室所得KMnO,产率较低,请提出优化该装置的措施以提高KMnO:产率:(写出一条即可)。【答案】(1)启普发生器(1分)(2)3K2 MnO+4CO2+2H2O-2KMnO+MnO2+4KHCO3 (2)(3)抽滤或过滤(1分)温度过高,高锰酸钾会分解(2分)316000a(4)当滴入最后半滴溶液时,溶液由无色变为浅红色且30s内不变色(2分)%(2分)67(V2-V1)m(5)在装置1和装置2之间添加盛有饱和碳酸氢钠溶液的洗气瓶,除去HC1气体(2分)【解析】(1)根据装置图可知,装置1为启普发生器。(2)反应物为二氧化碳气体和锰酸钾,产物之一为高锰酸钾,同时有MO2生成,结合元素守恒可知还生成了碳酸氢钾,则根据得失电子守恒、原子守恒,可得该反应的化学方程式为3K2MnO,十4CO2十2H2O2KMnO,+MnO2+4KHCO3.(3)反应完成后,装置2中为高锰酸钾溶液和二氧化锰固体的混合物,第一步操作为抽滤或过滤,然后蒸发浓缩、冷却结晶、烘干,在蒸发浓缩时,由于高锰酸钾不稳定,温度过高易发生分解反应,所以一般温度不宜过高,防止高锰酸钾分解。(4)用KMnO4溶液滴定草酸钠溶液,当恰好反应完全时,再滴入KMnO4溶液,溶液会变为紫色,因此判断滴定终点的现象是当滴入最后半滴溶液时,溶液由无色变为浅红色且30s内不褪色,即为终点。αg草酸钠的物质的量nNa,C,0,)=184m0l,根据化学方程式中物质转化关系可知,n(参与滴定的高锰酸钾)=后n(草酸钠)2m0l,n(样品中的高锰酸钾)=85×m0l=570V万mol,m(高锰酸钾)=n(高锰酸钾)XM(高20aa100锰酸钾)67(V2-V)8,所以产品纯度=3160am (KMnO)316000am(样品)×100%=67(V2-V1)m%。(5)产率低的原因是启普发生器中的盐酸挥发,有HC1气体进入装置2中,和生成的高锰酸钾发生氧化还原反应,消耗高锰酸钾,因此改进的措施可以是在气体进入装置2之前进行除杂操作,可以在装置1和装置2之间添加盛有饱和碳酸氢钠溶液的洗气瓶,除去HC1气体。

以上就是英语周报九年级上册期2023答案,更多英语周报答案请关注本网站。
本文地址: http://www.ncneedu.cn/post/26405.html
文章来源:admin
版权声明:除非特别标注,否则均为本站原创文章,转载时请以链接形式注明文章出处。
- 04-05 1 英语周报八年级新目标答案第29期
- 04-05 2 英语周报八年级新目标scc答案5
- 04-05 3 英语周报答案七年级上册2022-2023
- 04-05 4 英语周报答案2022~2023
- 04-05 5 英语周报答案八年级下册2023
- 04-05 6 英语周报答案九年级人教版2023
- 02-24 7 时代英语报2022-2023 test7答案
- 02-24 8 双语报答案20222023高三
- 02-24 9 双语报浙江W版中考专版第35期答案
- 02-24 10 双语报英语答案高三课标24期
- 英语周报八年级新目标答案第29期
2023-04-05admin
- 英语周报八年级新目标scc答案5
2023-04-05admin
- 英语周报答案七年级上册2022-2023
2023-04-05admin
- 英语周报答案2022~2023
2023-04-05admin
- 英语周报答案八年级下册2023
2023-04-05admin
- 英语周报答案九年级人教版2023
2023-04-05admin
- 时代英语报2022-2023 test7答案
2023-02-24admin
- 双语报答案20222023高三
2023-02-24admin
- 双语报浙江W版中考专版第35期答案
2023-02-24admin
- 双语报英语答案高三课标24期
2023-02-24admin
