
英语周报2021-2022外研版C1版广东省A卷答案

12.B解析:X、Y为短周期元素,X的周期数是族序数的3倍,则X是第三周期第IA族的Na元素;X的质子数z=11,其质量数为2×11+1=23,根据Na+HeY+H,Y的质子数p11+2-1=12、质量数v=23+4-1=26,则Y为Mg元素。A.根据分析,Y的质量数为26,A错误;B.X、Y的简单离子依次为Na、Mg2+,两种离子都具有与Ne原子相同的电子层结构,B正确;C.X的常见氧化物有Na2O、Na2O2,Mg的常见氧化物为MgO,Na2O、MgO中只有离子键,而Na2O2中既有离子键又有非极性共价键,C错误;D.X的最高价氧化物对应的水化物为NaOH,NaOH属于强碱,Mg的最高价氧化物对应的水化物为Mg(OH)2,Mg(OH)2属于中强碱,NaOH与Mg(OH)2不反应,D错误;选B。1个


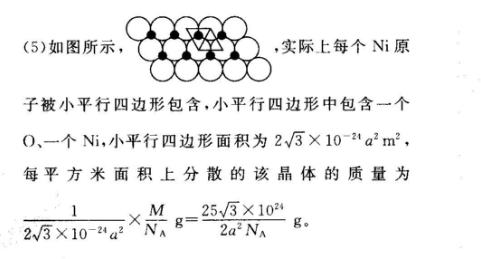
4.(13分)(1)3d4s2(1分)28(1分)(2)sp(1分)N2(或CO)(1分,其他合理答案也给分)大于(1分)NH1中N的孤对电子形成配位键后,使N一H成键电子对所受斥力减小,键角增大(2分)(3)Cu的价电子排布式为3d°,处于全充满状态,而Ni的价电子排布式为3d4s,因此Cu'比Ni稳定,更难失电子(2分)(4)(1,,)(2分)(5)25√3×10242a2N、(2分)【解析】(1)基态Ni原子的核外电子排布式为1s2s22p3s23p53d4s2,则价电子排布式为3d°4s2;有28种不同运动状态的电子。(2)CN中碳原子的价层电子对数目为1+4+=2,则碳原子的杂化方式为sp;与CN-互为等电子体的一种分子是N2或CO;NH3分子中N原子有1个孤对电子,NH3中N的孤对电子形成配位键后,使N—H成键电子对所受斥力减小,键角增大。(3)Cu+的价电子排布式为3d°,最外电子层处于全充满状态,而Ni的价电子排布式为3d4s',故Cu比Ni的第二电离能大(4)C在x、y、z轴上的投影分别是1、、2,所以C的坐标参数为(1,22)(5)如图所示,,实际上每个Ni原子被小平行四边形包含,小平行四边形中包含一个O、一个Ni,小平行四边形面积为23×10-2a2m2,每平方米面积上分散的该晶体的质量为M25√3×1023×10Xy-g2a NAg

以上就是英语周报2021-2022外研版C1版广东省A卷答案,更多英语周报答案请关注本网站。
本文地址: http://www.ncneedu.cn/post/22590.html
文章来源:admin
版权声明:除非特别标注,否则均为本站原创文章,转载时请以链接形式注明文章出处。
- 04-05 1 英语周报八年级新目标答案第29期
- 04-05 2 英语周报八年级新目标scc答案5
- 04-05 3 英语周报答案七年级上册2022-2023
- 04-05 4 英语周报答案2022~2023
- 04-05 5 英语周报答案八年级下册2023
- 04-05 6 英语周报答案九年级人教版2023
- 02-24 7 时代英语报2022-2023 test7答案
- 02-24 8 双语报答案20222023高三
- 02-24 9 双语报浙江W版中考专版第35期答案
- 02-24 10 双语报英语答案高三课标24期
- 英语周报八年级新目标答案第29期
2023-04-05admin
- 英语周报八年级新目标scc答案5
2023-04-05admin
- 英语周报答案七年级上册2022-2023
2023-04-05admin
- 英语周报答案2022~2023
2023-04-05admin
- 英语周报答案八年级下册2023
2023-04-05admin
- 英语周报答案九年级人教版2023
2023-04-05admin
- 时代英语报2022-2023 test7答案
2023-02-24admin
- 双语报答案20222023高三
2023-02-24admin
- 双语报浙江W版中考专版第35期答案
2023-02-24admin
- 双语报英语答案高三课标24期
2023-02-24admin
