
2018-2022英语周报八年级下新目标44期答案


13.【答案】C【解析】X原子的最外层电子数是Z原子内层电子数的一半,Z是构成岩石与许多矿物的基本元素,Z是SiZ原子内层电子数为10,X原子的最外层电子数是5、由题意可知X是N,X、Z、W最外层电子数之和为11,W为Ca,Y与W形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃所以Y是F。元素X的简单氢化物为NH3与Cl2反应有白烟(NH4C)生成,A项正确;W的氢化物为C2,CaH2+2H1O=ca(OH)2+2H12t,B项正确:Y2为F2,F2与K溶液反应时,先与水反应,C项错误;X的最高价氧化物的水化物为HNO,乙的最高价氧化物的水化物为H5s3,HNO的酸性比H2siO酸性强,D项正确

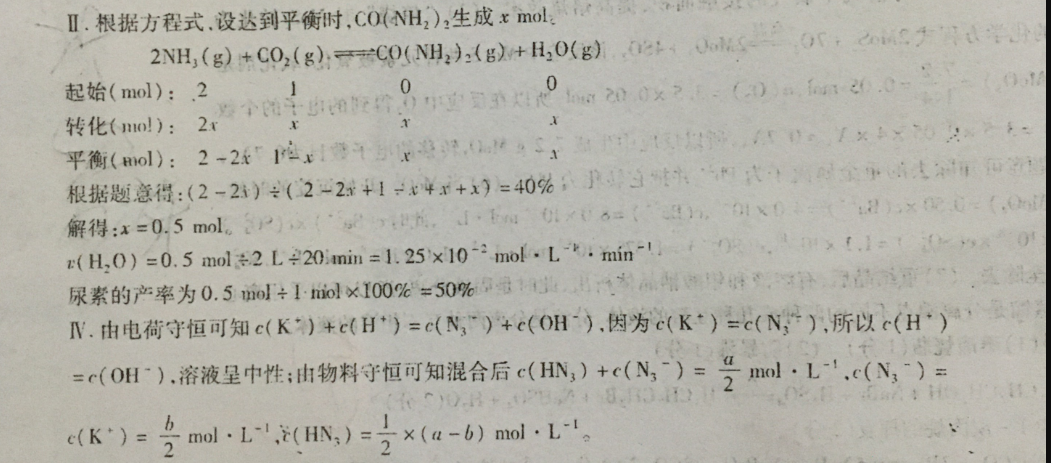
2分)②等于28.【答案11.①△H2>△H>MH(2分)x(NH),c(CO2)1.1.25×102md·L,min(2分)50%(2分)增大压强或增大NH,浓度或CO2浓度Ⅲ.7前反应未达到平衡,温度越高反应速率越快,相同时间内尿素的质量越多,7后反应都已(1分)经达到平衡,温度越高平衡转化率越低,尿素的产量越低(2分)N.中(1分)x(a-6)(2分)【解析】1.1由图1可知,H1<0、△B12>0,△H=3B1+△H2,所以3H>B>31:2NH1(g)+CO3g)=C0NH2):(1)+H20(1)生成物是液体,浓度视为常数,所以K=2H1 NCOONH1(s)==2NH4(g)+CO2(g),因为反应物是固体,生成的NH2与c2(NH)·c(CO2)CO2的物质的量之比为2:1,当达到平衡后再通入0.2moNH3和0.1 miol CO3,NH12与CO2的物质的量之比仍为2:1:=(NH)c(CO),化学平衡常数仅受温度影响,所以达平衡后CO浓度等于原平衡时CO2浓度里3Ⅱ.根据方程式,设达到平衡时,CO(NH2)2生成xmol2NH2(g)+CO2(g)CO(NH2)2(B)+H20(g),(2,0,C起始(mol):20个图计的20转化(nl):2平衡(mol):2-2x1xx92,根据题意得:(2-2)÷(22+1x+x+x)=40%:当解得:x=0.5ml(6(H2O)=0.5ml÷2L÷20min=1.25×10-mol·L,min-1尿素的产率为0.5ml÷1mol×100%=50%导,R.由电荷守恒可知(K”)+(H”)=c(N“)+c(OH1),因为(K2)=c(N),所以(H”)=c(OH-),溶液呈中性;由物料守恒可知混合后c(HN2)+c(N3)=2mol·L-1,c(N3)=c(K)=2mol.L-,(HN、)=-x(a-b)mo·L。

以上就是2018-2022英语周报八年级下新目标44期答案,更多英语周报答案请关注本网站。
本文地址: http://www.ncneedu.cn/post/19955.html
文章来源:admin
版权声明:除非特别标注,否则均为本站原创文章,转载时请以链接形式注明文章出处。
- 04-05 1 英语周报八年级新目标答案第29期
- 04-05 2 英语周报八年级新目标scc答案5
- 04-05 3 英语周报答案七年级上册2022-2023
- 04-05 4 英语周报答案2022~2023
- 04-05 5 英语周报答案八年级下册2023
- 04-05 6 英语周报答案九年级人教版2023
- 02-24 7 时代英语报2022-2023 test7答案
- 02-24 8 双语报答案20222023高三
- 02-24 9 双语报浙江W版中考专版第35期答案
- 02-24 10 双语报英语答案高三课标24期
- 英语周报八年级新目标答案第29期
2023-04-05admin
- 英语周报八年级新目标scc答案5
2023-04-05admin
- 英语周报答案七年级上册2022-2023
2023-04-05admin
- 英语周报答案2022~2023
2023-04-05admin
- 英语周报答案八年级下册2023
2023-04-05admin
- 英语周报答案九年级人教版2023
2023-04-05admin
- 时代英语报2022-2023 test7答案
2023-02-24admin
- 双语报答案20222023高三
2023-02-24admin
- 双语报浙江W版中考专版第35期答案
2023-02-24admin
- 双语报英语答案高三课标24期
2023-02-24admin
