
英语周报七年级下册2019到2022第49版答案
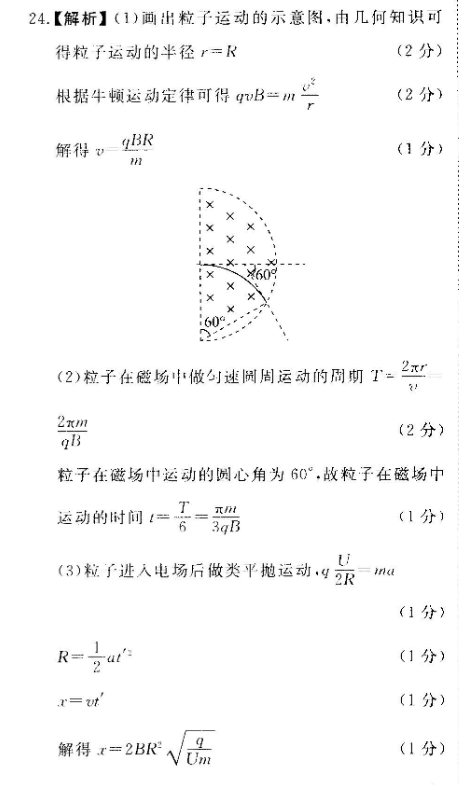
【解析】(1)画出粒子运动的示意图,由几何知识可得粒子运动的半径r=R(2分)根据牛顿运动定律可得qvB=分解得(1分x60(2)粒子在磁场中做速闶周运动的周蚵TnBs(2分)粒子在磁场中运动的圆心角为60°,故粒子在磁场中运动的时间=6-3aB3(1分〕(3)粒子进入电场后做类平拋运动,o=ma(1分R=-d(1分)(1分解得x=2BR(1分)



7.(14分I.(1)12MnO+36H+5C2H1==12Mn2+10CO2+28H2O(2分)Ⅱ.(2)1:2(2分)(3)KMnO4受热易分解(1分)(4)①AE(2分)②滴入最后一滴标准溶液,溶液褪色,且半分钟内不恢复红色(2分)③88%(2分)Ⅲ.(5)C!也能被酸性KMnO)4溶液氧化(1分)(6)电流表指针发生偏转,N池中溶液顏色逐渐变浅(直至褪色),M池中溶液颜色逐渐变为黄色(2分)【解析】I,(1)酸性KMn()1溶液将乙烯氧化为CO2,反应的离子方程式为12MnO1+36H++5C2H,=12Mn2+10CO2+28H2OⅡ.(2)K:Mn()4发生的歧化反应中KMn(.为氧化产物.MnO2为还原产物,由得失电子守恒知,氧化剂与还原剂的质量之比为1:2。(3)KMnO4受热易分解,故不能通过蒸发结晶的方法获得产品(4)①配制500ml述溶液需用称最装置,但托盘天平达不到题中所要求的精确度,需要500m1.容量瓶,溶解时需要烧杯,定容时需耍胶头滴管,不需耍牛角管。故选A、E②滴定终点的现象为滴入最后一滴标准溶液,溶液褪色,且半分钟内不恢复红色。③根据得失电子守恒可得关系式:2KMnO5Na2C2O4、K2MnO~2Na2C2O4,设3.6000g产品中KMnO4、K2MnO1的物质的量分别为xmolymol,列式得158x+197y=3.6000、2+2y=0.15000.0223×23.0,解得x≈0.02,则产品中KMnO的质量分数为9.02mol×158g·mo×100%3.6000g≈88%。Ⅲ.(5)Cˉ也能被酸性KMnO溶液氧化,故盐桥中使用KNO)2而不使用KCl(6)该装置中电流表指针发生偏转,Mn)逐渐被还原为Mn2+,故N池中溶液颜色逐渐变浅;Fe2+逐渐被氧化为Fe3-,故M池中溶液颜色逐渐变为黄色。

以上就是英语周报七年级下册2019到2022第49版答案,更多英语周报答案请关注本网站。
本文地址: http://www.ncneedu.cn/post/18473.html
文章来源:admin
版权声明:除非特别标注,否则均为本站原创文章,转载时请以链接形式注明文章出处。
- 04-05 1 英语周报八年级新目标答案第29期
- 04-05 2 英语周报八年级新目标scc答案5
- 04-05 3 英语周报答案七年级上册2022-2023
- 04-05 4 英语周报答案2022~2023
- 04-05 5 英语周报答案八年级下册2023
- 04-05 6 英语周报答案九年级人教版2023
- 02-24 7 时代英语报2022-2023 test7答案
- 02-24 8 双语报答案20222023高三
- 02-24 9 双语报浙江W版中考专版第35期答案
- 02-24 10 双语报英语答案高三课标24期
- 英语周报八年级新目标答案第29期
2023-04-05admin
- 英语周报八年级新目标scc答案5
2023-04-05admin
- 英语周报答案七年级上册2022-2023
2023-04-05admin
- 英语周报答案2022~2023
2023-04-05admin
- 英语周报答案八年级下册2023
2023-04-05admin
- 英语周报答案九年级人教版2023
2023-04-05admin
- 时代英语报2022-2023 test7答案
2023-02-24admin
- 双语报答案20222023高三
2023-02-24admin
- 双语报浙江W版中考专版第35期答案
2023-02-24admin
- 双语报英语答案高三课标24期
2023-02-24admin
